Si conociésemos qué tipo de patrón dietético y alimentos necesitamos según nuestra genética para mantener un correcto estado de salud, ¿nos adaptaríamos a ello? ¿Existe una dieta personalizada según nuestros genes?
Sabemos que unos hábitos alimentarios deben ir acorde a nuestro estilo de vida, gustos, preferencias, para que así puedan perdurar en el tiempo. Sin embargo, existe otro concepto de nutrición personalizada que no involucra nuestros gustos sino nuestro material genético: nutrición de precisión.
Laura Pérez Naharro – Unidad de Nutrición Neolife
Nutrigenética y nutrigenómica
Sabemos que la dieta es un factor modulador de nuestros genes, capaz de alterar secuencias de ADN y predisponer a determinadas patologías a través de mecanismos de epigenética; y al mismo tiempo, cada persona tiene una variabilidad genética en base a la cual podemos beneficiarnos o incluso resultar perjudicial si seguimos las recomendaciones nutricionales generales, por tanto, ¿una dieta según nuestros genes podría convertirse en un nuevo concepto de dieta personalizada?
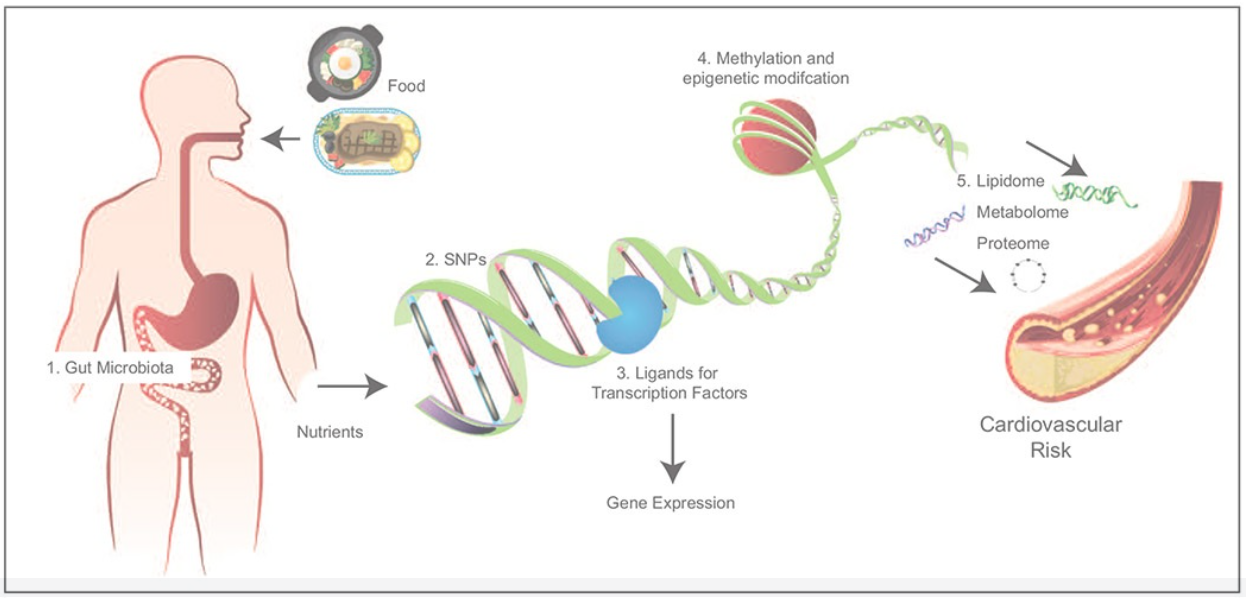
Mecanismos moleculares para las interacciones nutrigenómicas/nutrigenéticas en el riesgo de enfermedades cardiovasculares
La nutrigenética investiga las diferentes variantes genéticas, conocidas como polimorfismos, tanto de forma individual como poblacional, y su riesgo para desarrollar ciertas enfermedades para así establecer recomendaciones nutricionales específicas, con el objetivo de reducir o evitar que tenga lugar dicha enfermedad a la que estamos predispuestos.
Un ejemplo para comprender esta variabilidad individual genética es el hecho de que personas con un mismo patrón alimentario y estilo de vida, tienen diferencias en cuanto a presión arterial y niveles de colesterol. Otro caso de variabilidad genética es la fenilcetonuria (PKU). Las personas con esta patología deben evitar de por vida alimentos que contengan fenilalanina (un aminoácido presente en la gran mayoría de alimentos proteicos y aspartamo), debido a una incapacidad por descomponer dicha molécula al presentar mutaciones en el gen que codifica la enzima responsable de convertir la fenilalanina en tirosina.
Hemos mencionado antes que las variaciones individuales se conocen con el nombre de polimorfismos, pero sin especificar de qué se trata. Pues bien, consiste en una diferencia en la secuencia del ADN que se presenta en más del 1% de la población. Normalmente, esta variación ocurre en un solo nucleótido y por ello se conocen como polimorfismos de un solo nucleótido (SNP).
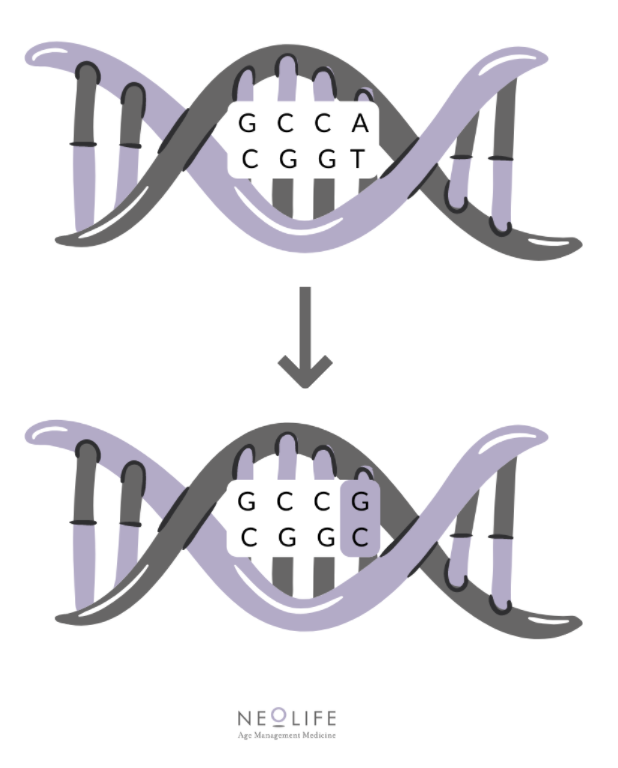
A continuación, vamos a detallar algunos de los polimorfismos identificados y sus efectos en la salud:
Sensibilidad a la cafeína
Seguro que conocemos a alguien, o incluso nosotros mismos, a quien la cafeína no le sienta muy bien o, por el contrario, que no le da el efecto deseado y requiere de una mayor dosis.
La sensibilidad a la cafeína viene determinada por el gen CYP1A2.
Personas que tienen el SNP rs762551 en el gen CYP1A2 presentan una disminución de la actividad de la enzima encargada de metabolizar la cafeína, la metilzantina. Por lo que tienen una hipersensibilidad a este compuesto y por ello se consideran metabolizadores lentos de la cafeína. Estas personas, presentan un mayor riesgo de sufrir taquicardias, aumento de la rigidez aórtica, mayor velocidad de la onda del pulso, inflamación vascular y aumento de las catecolaminas después de 3 horas de consumo de cafeína en comparación con metabolizadores rápidos.
Polimorfismos en la apolipoproteína E (apoE)
La diversidad entre individuos en respuesta a una misma ingesta de grasas en la dieta ha dado lugar al estudio de variantes genéticas implicadas en el metabolismo de las grasas, en especial, en el gen que codifica para apoE.
El polimorfismo más conocido es la mutación de apoE épsilon, que da lugar a tres alelos diferentes: E2, E3 y E4.
Aproximadamente el 61 % de los caucásicos son homocigotos E3/E3, el 25 % son portadores de E4 (E3/E4 o E4/E4), el 12 % son portadores de E2 (E2/E2 o E2/E3), y el 2 % restante presentan un genotipo E2/E4.
El impacto del genotipo apoE en el riesgo de ECV ha sido ampliamente investigado durante los últimos 30 años. Se ha observado un aumento medio en el riesgo de ECV del 40-50 % en los portadores de E4 en relación con el genotipo E3/E3, sin diferencias aparentes para los subgrupos E2 y E3
Esto se debe a que los portadores del alelo E4 tienen una mayor concentración de colesterol LDL que las personas portadoras del alelo E3. En relación con el patrón alimentario, los individuos con genotipos E4/4 y E4/3 han demostrado una mejor respuesta a una disminución del aporte de grasas saturadas, en concreto el genotipo E4/3, consiguiendo bajar en mayor proporción las concentraciones plasmáticas de lípidos (colesterol total, LDL, TG y apoB) que el genotipo E4/4.
Por tanto, aquellas personas con genotipo E4/4 deben prestar aún más atención a su estilo de vida, ya que genéticamente están predispuestas a presentar una mayor concentración de LDL, lo cual se relaciona directamente con la formación de placa de ateroma.
Polimorfismos en PPAR γ
Siguiendo el contexto del metabolismo de las grasas, nos encontramos con PPAR γ, un factor de transcripción nuclear implicado en la regulación de una serie de genes clave en la β-oxidación de los ácidos grasos y la inflamación
Actualmente es un gen de especial atención en la investigación, ya que se encuentra involucrado en el desarrollo de la obesidad y, por tanto, con las ECV.
Personas que presentan el SNP pro12ala en este gen (PPAR-γ) tienen una mayor predisposición al aumento de grasa y resistencia a la insulina.
Polimorfismos en NLRP3
El consumo de grasas saturadas en aquellas personas que presenten la variante rs12143966 en el gen NLRP3, manifiestan mayores niveles de insulina en ayunas. Por lo que tienen un mayor riesgo de resistencia a la insulina y diabetes tipo 2, siendo el consumo de grasas saturadas su principal foco de atención.
Polimorfismos y consumo de ácidos grasos poliinsaturados (AGPI)
Tanto por la capacidad de regular el perfil lipídico como por la reducción de la inflamación, la ingesta de ácidos grasos poliinsaturados (omega-6 y omega-3), se ha relacionado con una disminución del riesgo de ECV. Está demostrado que los ácidos grasos omega-3 (EPA/DHA) ejercen efectos cardioprotectores. Sin embargo, ¿qué ocurre con las variaciones genéticas? Siguiendo las recomendaciones actuales de consumo de estos ácidos grasos, ¿puede haber sujetos que tenga un efecto perjudicial en su salud?
Polimorfismos en los genes FADS reducen la síntesis del DHA y también de ARA (ácido araquidónico). Los portadores de alelos menores de FADS presentan un desequilibrio omega 3:6 generando un estado inflamatorio y, por tanto, un mayor riesgo de ECV. De esta forma, las recomendaciones en estas personas en cuanto a la ingesta de EPA y DHA, deben ser mayores con respecto a las de la población general.
Conclusión
La investigación de las interacciones gen-dieta es fundamental para obtener información que nos permita actuar en el ámbito de la prevención. Hoy en día disponemos de pruebas genéticas para conocer los diferentes polimorfismos estudiados hasta fecha: los microarrays.
No debemos olvidar, que más allá de los nutrientes individuales, lo realmente importante es la interacción entre grupos de alimentos y nutrientes. No se trata de dar recomendaciones acerca de nutrientes específicos, sino de patrones dietéticos. La nutrición es una combinación compleja de macronutrientes, micronutrientes y alimentos con propiedades similares. Resultada complicado separar el efecto de un solo nutriente de otros.
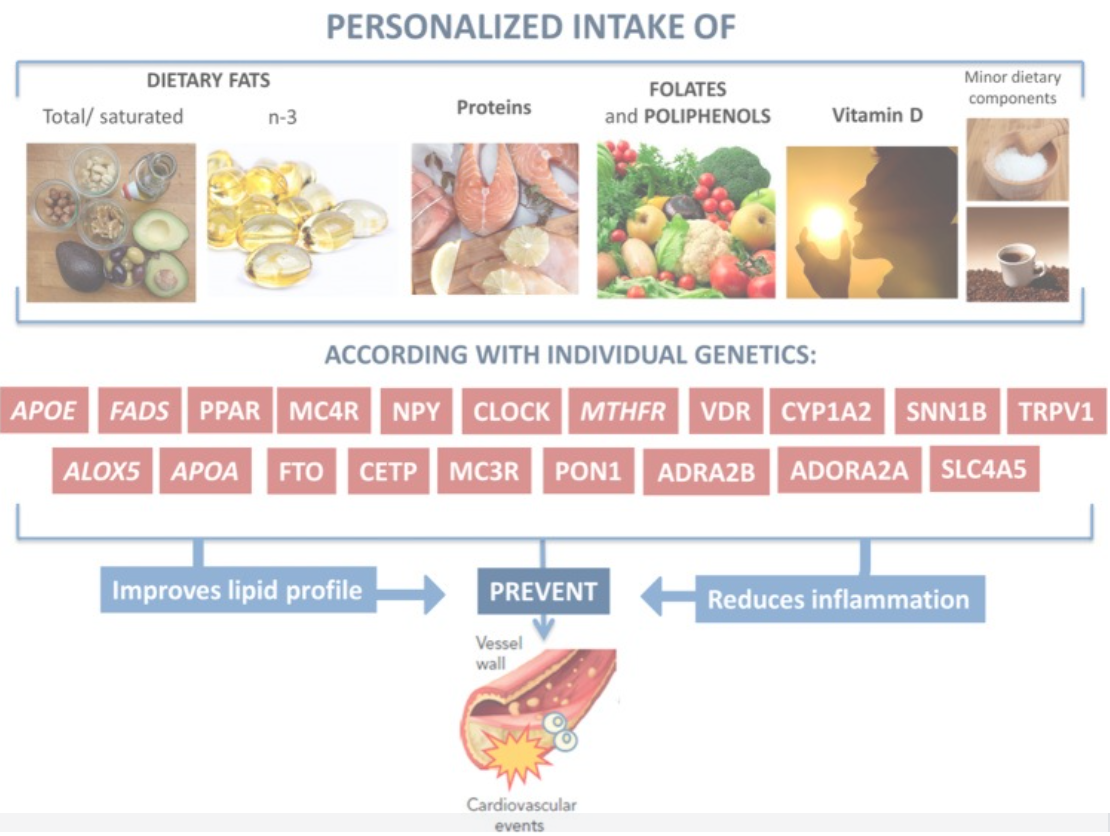
Ejemplo de intervención personalizada diseñada para reducir el riesgo de ECV en pacientes que presentan obesidad según las diferentes variantes genéticas
BIBLIOGRAFÍA
(1) Lovegrove, J. A., & Gitau, R. (2008). Personalized nutrition for the prevention of cardiovascular disease: a future perspective. Journal of human nutrition and dietetics : the official journal of the British Dietetic Association, 21(4), 306–316. https://doi.org/10.1111/j.1365-277X.2008.00889.x
(2) Ferguson, J. F., Allayee, H., Gerszten, R. E., Ideraabdullah, F., Kris-Etherton, P. M., Ordovás, J. M., Rimm, E. B., Wang, T. J., Bennett, B. J., & American Heart Association Council on Functional Genomics and Translational Biology, Council on Epidemiology and Prevention, and Stroke Council (2016). Nutrigenomics, the Microbiome, and Gene-Environment Interactions: New Directions in Cardiovascular Disease Research, Prevention, and Treatment: A Scientific Statement From the American Heart Association. Circulation. Cardiovascular genetics, 9(3), 291–313. https://doi.org/10.1161/HCG.0000000000000030
(3) Murphy, A. M., Smith, C. E., Murphy, L. M., Follis, J. L., Tanaka, T., Richardson, K., Noordam, R., Lemaitre, R. N., Kähönen, M., Dupuis, J., Voortman, T., Marouli, E., Mook-Kanamori, D. O., Raitakari, O. T., Hong, J., Dehghan, A., Dedoussis, G., de Mutsert, R., Lehtimäki, T., Liu, C. T., … Roche, H. M. (2019). Potential Interplay between Dietary Saturated Fats and Genetic Variants of the NLRP3 Inflammasome to Modulate Insulin Resistance and Diabetes Risk: Insights from a Meta-Analysis of 19 005 Individuals. Molecular nutrition & food research, 63(22), e1900226. https://doi.org/10.1002/mnfr.201900226
(4) Barrea, L., Annunziata, G., Bordoni, L., Muscogiuri, G., Colao, A., Savastano, S., & Obesity Programs of nutrition, Education, Research and Assessment (OPERA) Group (2020). Nutrigenetics-personalized nutrition in obesity and cardiovascular diseases. International journal of obesity supplements, 10(1), 1–13. https://doi.org/10.1038/s41367-020-0014-4


