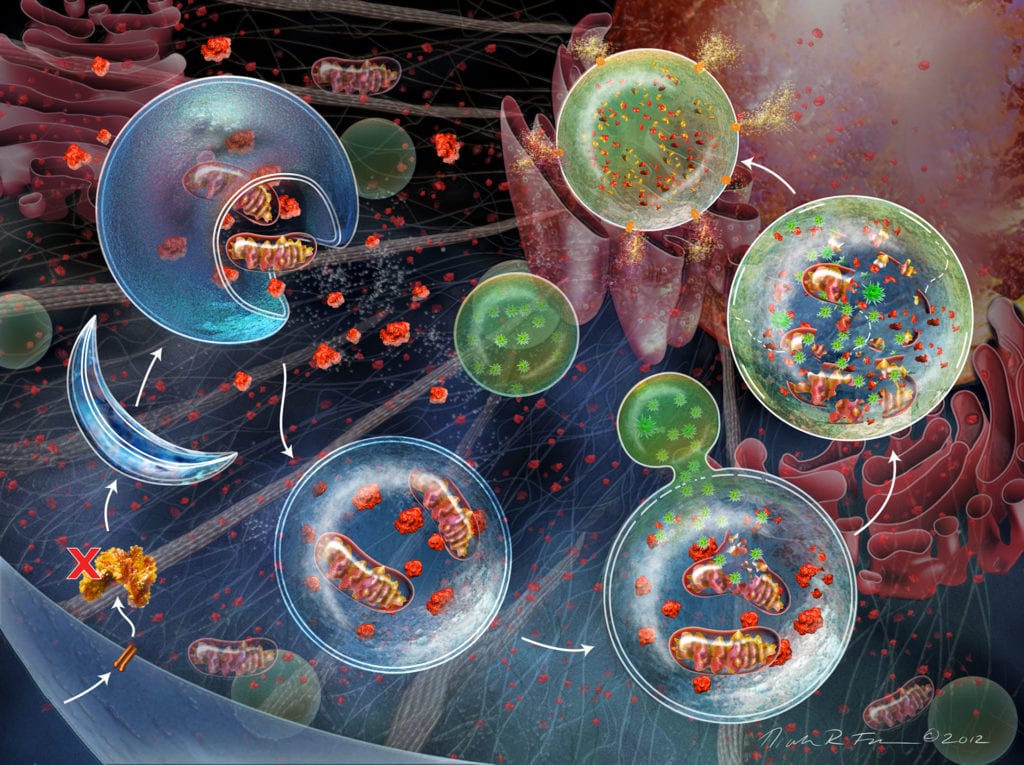
La autofagia es un proceso celular altamente conservado entre especies que implica la degradación y el reciclaje de componentes celulares. Es esencial para la homeostasis, el desarrollo y la supervivencia celular en condiciones de estrés.
La autofagia desempeña un papel fundamental en la degradación de proteínas mal plegadas y orgánulos dañados, que son características de enfermedades neurodegenerativas.
Dr. Alfonso Galán – Equipo Médico Neolife
La restricción calórica (RC) ha demostrado mejorar la autofagia. Los estudios indican que reducir la ingesta calórica sin malnutrición puede aumentar los marcadores de autofagia.
Escuchamos hablar mucho sobre autofagia y su relación con el proceso de envejecimiento, de si deberíamos, por ejemplo, hacer ayunos o ayuno intermitente (AI) para activar esta cosa que al parecer es genial para no envejecer, ¿verdad?.
Queremos dedicar este Newsletter a explicar qué es, qué sabemos sobre ella, qué relación tiene con la enfermedad en humanos, si es conveniente activarla, y qué formas tenemos de hacerlo con la evidencia científica en la mano.
¿Qué es?
La autofagia es un proceso celular altamente conservado entre especies que implica la degradación y el reciclaje de componentes celulares. Es esencial para la homeostasis, el desarrollo y la supervivencia celular en condiciones de estrés. La desregulación de la autofagia se ha implicado en una amplia gama de enfermedades humanas, incluidos los trastornos neurodegenerativos, el cáncer, las enfermedades infecciosas y las afecciones metabólicas.
Mecanismos de la autofagia
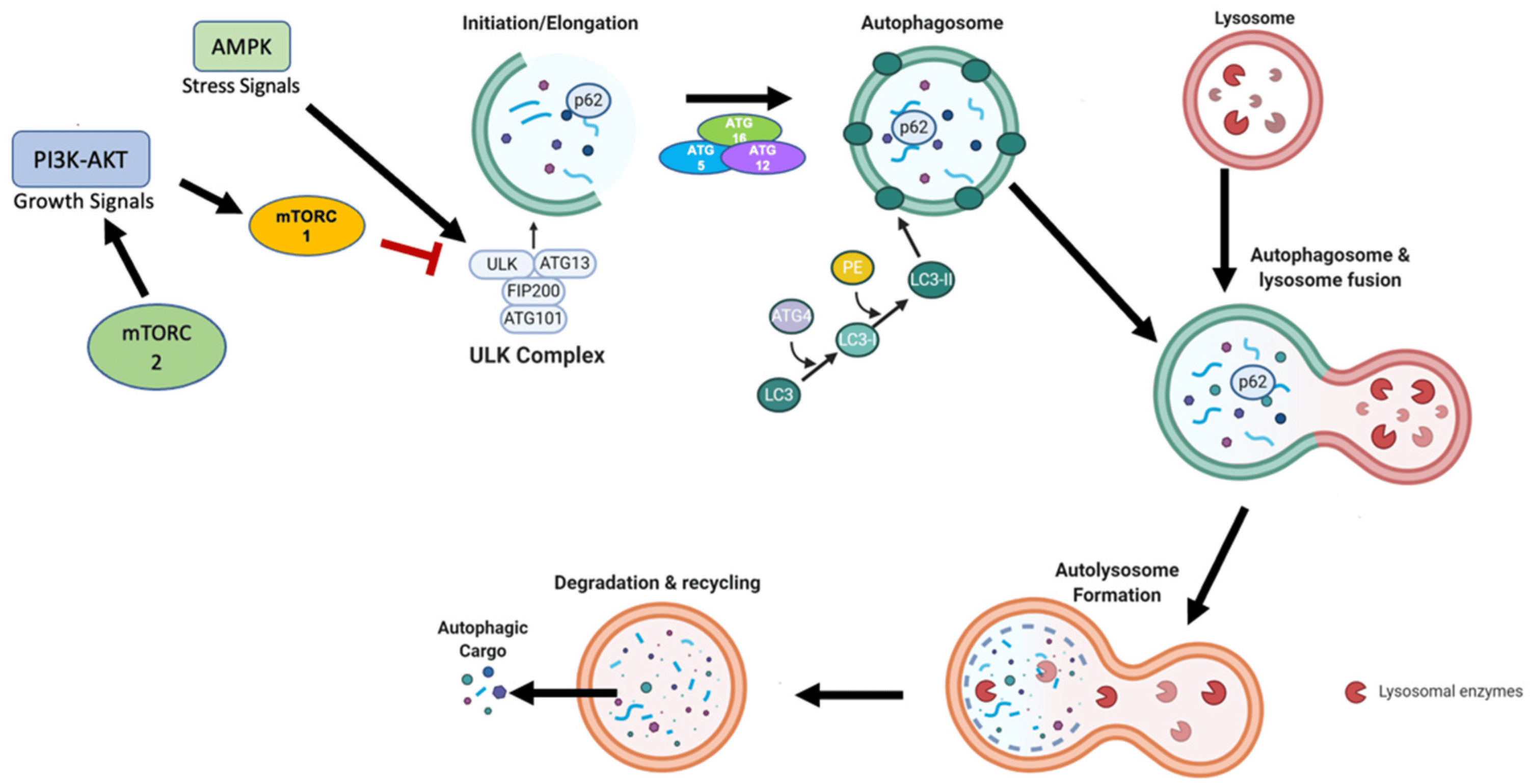
La autofagia implica la formación de unas vesículas de doble membrana llamadas autofagosomas, que engullen componentes celulares y se fusionan con los lisosomas para su degradación. Las proteínas clave involucradas en la autofagia incluyen proteínas ATG (relacionadas con la autofagia), que regulan la iniciación, la nucleación y la elongación de los autofagosomas. El proceso está estrictamente regulado por varias vías de señalización, incluida la vía mTOR (mechanistic target of Rapamycin), que inhibe la autofagia en condiciones ricas en nutrientes. De esta vía hablamos hace tiempo ampliamente aquí.
Autofagia en enfermedades neurodegenerativas
La autofagia desempeña un papel fundamental en la degradación de proteínas mal plegadas y orgánulos dañados, que son características de enfermedades neurodegenerativas como el Alzheimer, el Parkinson y la enfermedad de Huntington. La autofagia alterada conduce a la acumulación de agregados de proteínas tóxicas, lo que contribuye a la muerte neuronal. La mejora de la autofagia se ha propuesto como una estrategia terapéutica para eliminar estos agregados y proteger las neuronas.
- Enfermedad de Alzheimer: la autofagia está involucrada en la eliminación de las proteínas beta-amiloide y tau, que forman placas y ovillos en el cerebro. La desregulación de la autofagia contribuye a la acumulación de estas proteínas, exacerbando la enfermedad.
- Enfermedad de Parkinson: las mutaciones en genes como PINK1 y Parkin, que están involucrados en la mitofagia (un tipo específico de autofagia que degrada las mitocondrias dañadas), están relacionadas con formas familiares de la enfermedad de Parkinson. Mejorar la mitofagia puede ayudar a eliminar las mitocondrias disfuncionales y proteger las neuronas dopaminérgicas.
- Enfermedad de Huntington: la proteína huntingtina mutada forma agregados que son tóxicos para las neuronas. La autofagia ayuda a degradar estos agregados, y la mejora de la autofagia se ha mostrado prometedora en modelos preclínicos de la enfermedad de Huntington.
Autofagia en el cáncer
La autofagia tiene un papel complejo en el cáncer, actuando como supresor tumoral y promotor del crecimiento tumoral dependiendo del contexto. En las primeras etapas del cáncer, la autofagia puede prevenir el inicio del tumor al eliminar orgánulos y proteínas dañados que podrían provocar inestabilidad genómica, en nuestros genes, que lleva a que las células pierdan el control de la replicación.
Sin embargo, en tumores establecidos, la autofagia puede promover la supervivencia al proporcionar nutrientes a través de la degradación de los componentes celulares.
- Supresión de tumores: la autofagia evita la acumulación de mitocondrias dañadas y especies reactivas de oxígeno (ROS), que pueden causar daños en el ADN y promover la tumorigénesis.
- Promoción tumoral: en los tumores establecidos, la autofagia favorece la supervivencia de las células cancerosas en condiciones de estrés como la hipoxia y la privación de nutrientes. La inhibición de la autofagia en estos contextos puede sensibilizar a las células cancerosas a la quimioterapia y la radiación.
Autofagia en enfermedades infecciosas
La autofagia desempeña un papel crucial en la respuesta inmunitaria a las infecciones al degradar los patógenos intracelulares y presentar sus antígenos al sistema inmunitario. Sin embargo, algunos patógenos han desarrollado mecanismos para evadir o explotar la autofagia para su beneficio.
Autofagia en enfermedades metabólicas
La autofagia está implicada en la regulación del metabolismo de los lípidos, la sensibilidad a la insulina y la homeostasis energética. La desregulación de la autofagia se ha relacionado con enfermedades metabólicas como la obesidad, la diabetes tipo 2 y la enfermedad del hígado graso no alcohólico (NAFLD, non-alcoholic fatty liver disease) que ahora hemos decidido renombrar como enfermedad esteatótica hepática asociada a disfunción metabólica (metabolic dysfunction-associated steatotic liver disease, MASLD).
- Obesidad: la autofagia regula la diferenciación de los adipocitos y el metabolismo de los lípidos. La alteración de la autofagia en el tejido adiposo puede provocar la acumulación de gotas de lípidos y contribuir a la obesidad.
- Diabetes tipo 2: la autofagia está involucrada en el mantenimiento de la función de las células beta pancreáticas -que producen la Insulina- y la sensibilidad a la insulina.
- MASLD: la autofagia ayuda a degradar las gotas de lípidos en los hepatocitos. La autofagia alterada puede conducir a la acumulación de lípidos en el hígado, lo que contribuye a la formación de un hígado graso con sus graves consecuencias.
Bueno, entonces parece que si (con los matices en cáncer comentados) querríamos potenciar la autofagia para alejar la posibilidad de presentar este tipo de patologías.
¿Cómo fomentar la autofagia?
Tenemos varias formas, avaladas por buenos estudios para potenciar la autofagia:
- Restricción calórica: la restricción calórica (RC) ha demostrado mejorar la autofagia. Los estudios indican que reducir la ingesta calórica sin malnutrición puede aumentar los marcadores de autofagia. La RC activa vías como AMPK (proteína quinasa activada por AMP) e inhibe mTOR (objetivo mecanístico de la rapamicina), ambas cruciales para la inducción de la autofagia.
-
Ayuno intermitente: el ayuno intermitente (AI) implica ciclos entre períodos de alimentación y ayuno. Se ha demostrado que el AI promueve la autofagia al crear un cambio metabólico de glucosa a cuerpos cetónicos, lo que activa las vías autofágicas. Sobre esto haremos un pequeño aporte después.
- Ejercicio. el ejercicio físico regular es otra forma efectiva de inducir la autofagia. El ejercicio estimula la autofagia en varios tejidos, incluyendo músculo, hígado y cerebro, al activar AMPK e inhibir mTOR.
- Agentes farmacológicos: ciertos medicamentos y compuestos naturales pueden promover la autofagia. Estos incluyen:
- Rapamicina: un inhibidor de mTOR –de la que, de hecho, toma su nombre-q ue ha demostrado inducir la autofagia y extender la vida útil en varios organismos.
- Resveratrol: un compuesto natural encontrado en las uvas, algo controvertido, que activa SIRT1 y AMPK, promoviendo la autofagia.
- Espermidina: una poliamina que induce la autofagia y se ha relacionado con una mayor longevidad y mejor salud.
- Dieta cetogénica: una dieta cetogénica, alta en grasas y baja en carbohidratos, puede promover la autofagia al imitar el estado metabólico del ayuno. La producción de cuerpos cetónicos durante la cetosis activa las vías autofágicas.
- Ayuno a corto plazo: el ayuno a corto plazo, como ayunos de 24-48 horas, puede inducir una autofagia profunda, particularmente en las neuronas. Este método es efectivo para promover la eliminación de componentes celulares dañados.
Ok, lo prometido: ¿el famoso ayuno de 16h funciona? El concentrar toda nuestra ingesta en 8h del día ayuda a activar este importante mecanismo?
La respuesta es Sí, el ayuno de 16 horas ha demostrado activar la autofagia en humanos. Los mecanismos por los que lo hace los enumeramos a continuación:
Mecanismos de activación de la autofagia por ayuno de 16 horas
- Reducción de niveles de insulina:
- Durante el ayuno, los niveles de insulina en el cuerpo disminuyen. La insulina es una hormona que inhibe la autofagia, por lo que su reducción permite la activación de este proceso.
- Activación de AMPK e inhibición de mTOR:
- El ayuno activa la AMPK, una enzima que detecta los niveles bajos de energía en la célula. La AMPK promueve la autofagia al inhibir la vía mTOR (mammalian target of rapamycin), que es un inhibidor clave de la autofagia.
- Aumento de la producción de cuerpos cetónicos:
-
- El ayuno prolongado lleva a la producción de cuerpos cetónicos, que también pueden activar la autofagia. Los cuerpos cetónicos son una fuente alternativa de energía que se produce cuando las reservas de glucosa son bajas.
Estudios en humanos han demostrado que el ayuno intermitente, incluyendo el ayuno de 16 horas, puede activar marcadores de autofagia en humanos. Por ejemplo, se ha observado un aumento en la conversión de LC3-I a LC3-II, un marcador clave de la formación de autofagosomas. Además, se ha reportado una disminución en los niveles de p62/SQSTM1, lo que indica una mayor degradación de sustratos autofágicos.
Direcciones futuras
Como siempre decimos, se necesita más investigación para comprender completamente los mecanismos reguladores de la autofagia y su papel en diferentes enfermedades. Es muy importante para poder determinar si una estrategia funciona o no que dispongamos de biomarcadores específicos de autofagia fáciles de medir y así poder desarrollar terapias dirigidas que podamos utilizar en la práctica clínica, que es lo realmente importante.
BIBLIOGRAFÍA
(1) Lu J, Wu M, Yue Z. Autophagy and Parkinson’s Disease. Adv Exp Med Biol. 2020;1207:21-51. doi: 10.1007/978-981-15-4272-5_2. PMID: 32671737.
(2) Nechushtai L, Frenkel D, Pinkas-Kramarski R. Autophagy in Parkinson’s Disease. 2023 Sep 22;13(10):1435. doi: 10.3390/biom13101435. PMID: 37892117; PMCID: PMC10604695.
(3) Filali-Mouncef Y, Hunter C, Roccio F, Zagkou S, Dupont N, Primard C, Proikas-Cezanne T, Reggiori F. The ménage à trois of autophagy, lipid droplets and liver disease. 2022 Jan;18(1):50-72. doi: 10.1080/15548627.2021.1895658. Epub 2021 Apr 2. PMID: 33794741; PMCID: PMC8865253.
(4) Zhang Z, Yang X, Song YQ, Tu J. Autophagy in Alzheimer’s disease pathogenesis: Therapeutic potential and future perspectives. Ageing Res Rev. 2021 Dec;72:101464. doi: 10.1016/j.arr.2021.101464. Epub 2021 Sep 20. PMID: 34551326.
(5) Deretic V. Autophagy in inflammation, infection, and immunometabolism. 2021 Mar 9;54(3):437-453. doi: 10.1016/j.immuni.2021.01.018. PMID: 33691134; PMCID: PMC8026106.
(6) Qian H, Chao X, Williams J, Fulte S, Li T, Yang L, Ding WX. Autophagy in liver diseases: A review. Mol Aspects Med. 2021 Dec;82:100973. doi: 10.1016/j.mam.2021.100973. Epub 2021 Jun 11. PMID: 34120768; PMCID: PMC9585624.