Pese a su papel fundamental no se ha prestado la atención que merece a la mitocondria en el COVID-19. Explicaremos en las siguientes líneas su rol en esta enfermedad.
Los pacientes con COVID-19 presentan fundamentalmente una infección respiratoria baja. Desafortunadamente un número significativo de pacientes desarrolla lo que se llama una “Tormenta de citokinas”, un estado hiperinflamatorio asociado a estrés oxidativo, desregulación de la homeostasis del hierro, hipercoagulabilidad y formación de trombos.
Dr. Alfonso Galán González – Equipo Médico Neolife
El fundamental papel que juegan las mitocondrias en la función plaquetaria y la supervivencia.
En esta nueva entrada del blog queremos hacernos eco de las últimas investigaciones que relacionan la disfunción mitocondrial y las alteraciones de la microbiota intestinal con la patogenia de la enfermedad por Coronavirus, esto es, que están íntimamente implicadas en la manera que tiene el COVID-19 de afectarnos y causar daño.
En estas mismas páginas ya hemos hablado de la mitocondria como el probable eje del envejecimiento (aquí) y de la microbiota intestinal y las causas y consecuencias de la disbiosis.
Algunas evidencias, que ya también comentamos aquí, empezaban a apuntar a la mitocondria y sus mecanismos de producción de energía como algo que se afectaba de una manera u otra en la enfermedad por COVID-19. En estas siguientes líneas y de la forma más sencilla posible, vamos a desglosar qué sabemos sobre la afectación mitocondrial y de nuestra flora intestinal en la enfermedad por el coronavirus, y cómo la disfunción mitocondrial en la enfermedad también puede afectar la supervivencia de las plaquetas y su apoptosis, y potencialmente aumentar el riesgo de formación de trombos.
A modo de introducción
Como bien es sabido, el SARS-CoV-2 es un betacoronavirus que emergió en la cuidad de Wuhan (China) en Diciembre de 2019. Desde entonces la pandemia ha avanzado rápidamente causando, en el momento de escribir este artículo, más de 2,7 millones de muertes en todo el mundo.
Fundamentalmente los pacientes con COVID-19 presentan una infección respiratoria baja; Desafortunadamente un número significativo de pacientes desarrolla lo que se llama una “Tormenta de citokinas”, un estado hiperinflamatorio asociado a estrés oxidativo, desregulación de la homeostasis del hierro, hipercoagulabilidad y formación de trombos.
En este tiempo, varios biomarcadores se han asociado a peor pronóstico y mortalidad en pacientes críticamente enfermos como linfopenia, aumento de D-dímero e IL-6. En un estudio prospectivo sobre gran cantidad de pacientes en UCI se reportó un aumento del riesgo de muerte por cada 10% de aumento de IL-6 o D-dímero, señalando la relación tan íntima que la enfermedad por COVID-19 tiene con la inflamación sistémica y el daño endotelial.
El aumento de los niveles de Ferritina es un predictor también de mortalidad como lo es el estrés oxidativo. Mucha evidencia asocia inflamación con estrés oxidativo.
Pese a su papel fundamental controlando la oxidación y la formación de especies reactivas del oxígeno (ROS), no se ha hecho mucho caso a la mitocondria como parte importante de la patogénesis del COVID-19.
En estas siguientes líneas, explicaremos el rol teórico que las señales inflamatorias tienen agravando el daño mitocondrial oxidativo y cómo contribuye a las alteraciones de coagulación, ferroptosis (muerte celular por hierro) y disbiosis. También veremos como las mitocondrias extracelulares, sobre todo, las plaquetarias afectan a la coagulación y formación de trombos.
Mitocondria, estrés oxidativo e inflamación
Normalmente nuestros tejidos requieren un gran número de mitocondrias funcionantes para proporcionar energía y regular las funciones celulares de acuerdo a nuestras necesidades. Si hay más demanda, hacemos más mitocondrias por un proceso llamado mitogénesis mientras que el exceso de mitocondrias se elimina por un proceso llamado mitofagia. Defectos mitocondriales se han implicado en muchas patologías como la diabetes, enfermedad cardiovascular, enfermedades gastrointestinales, cáncer y envejecimiento. La mitocondria es la mayor fuente de especies reactivas del óxigeno (ROS) que por un lado lleva al funcionamiento celular normal, pero por otro se ha asociado a un aumento de estrés oxidativo intracelular.
Las Citoquinas proinflamatorias inducen aumentos de ROS mitocondrial. Estas citokinas inflamatorias como TNF-alfa y IL-6 se encuentran en la sangre de los pacientes COVID afectando la fosforilación oxidativa mitocondrial que lleva a la producción de ATP (nuestra moneda energética) y llevando a la formación de ROS. Esto afecta a la mitocondria de muchas maneras llevando a la muerte celular (apoptosis) en último extremo. Además, cuando estas mitocondrias dañadas liberan su contenido al citosol de la célula o al espacio extracelular esto lleva a la producción de citoquinas proinflamatorias como IL-1ß o IL-6. Ambas, marcadores de severidad de la enfermedad por COVID-19.
Muchos estudios, además, han mostrado el impacto de la disfunción mitocondrial en la respuesta inmune. Por ejemplo, la producción de citokinas proinflamatorias está muy aumentada en células pulmonares con mitocondrias disfuncionales.
El hierro y la disfunción mitocondrial
Los estudios sobre marcadores en COVID-19 han mostrado sin ninguna duda que el exceso de ferritina está asociado a la gravedad de la enfermedad y peor pronóstico. La ferritina además de ser un marcador de inflamación, se libera por las células que mueren.
Una de las dianas de estrés oxidativo mediado por el hierro, no es otra que la mitocondria. La función de la mitocondria depende de un correcto aporte de hierro y una alteración en sus niveles de hierro alterará su función llevando a estrés y muerte celular.
Además, sabemos que el hierro circulante no unido a proteínas cataliza la formación de más ROS que causan daño a los componentes celulares y mitocondrial también.
Llamamos ferroptosis a un fenómeno descubierto recientemente de muerte celular programada asociada al acúmulo de hierro. Se ha demostrado en numerosas infecciones por diferentes microorganismos. De forma peculiar, la ferroptosis causa alteraciones irreversibles de la morfología mitocondrial.
Estos datos proporcionan una base sólida a la idea de que la disfunción mitocondrial tiene un papel fundamental en la enfermedad por COVID-19.
Trombopenia e hipercoagulabilidad en COVID
Tenemos claro a estas alturas que las anormalidades en la coagulación están muy asociadas con la mortalidad por COVID. La comparación de parámetros de coagulación entre supervivientes y no supervivientes señalan el aumento de dímero-D, aumento de productos de degradación de la fibrina, aumento de tiempo de protrombina y de tromboplastina parcial activada.
También un descenso en el número de plaquetas se ha asociado a un aumento de mortalidad y es más frecuente en casos más severos sobre todo asociada a un cuadro de Coagulación intravascular diseminada (CID).
Mitocondrias extracelulares y Mitocondrias en plaquetas
Podemos curiosamente encontrar mitocondrias fuera de las células, esto es algo que no es muy conocido. Las mitocondrias extracelulares pueden encontrarse libres, encerradas por una membrana como dentro de plaquetas o en vesículas. Las mitocondrias fuera de la célula pueden inducir respuestas paracrinas o endocrinas y regulan la comunicación de célula a célula, la regeneración, la detección de peligros y provocan respuestas inmunes. Además de las mitocondrias extracelulares, se ha descrito la liberación de ADN mitocondrial (ADNmt) fuera de la célula durante la apoptosis.
El papel potencial de las mitocondrias libres circulantes o sus derivados en la sangre de pacientes con COVID-19 aún no se ha dilucidado, pero es algo que puede tener implicaciones hasta terapéuticas sobre todo pensando en el uso de plasma de pacientes recuperados para tratar a enfermos. Pero veamos algunas cosas más.
La plaqueta es una célula anucleada con la función fisiopatológica primaria de la hemostasia y la cicatrización de heridas. En ausencia de un núcleo que lo controle todo, la salud de las plaquetas está determinada en gran medida por la salud de sus mitocondrias.
El papel que juegan las mitocondrias en la función plaquetaria y la supervivencia es fundamental. La disfunción mitocondrial en la enfermedad también puede afectar la supervivencia de las plaquetas y su apoptosis, y potencialmente aumentar el riesgo de formación de trombos. Es importante destacar que recientemente se ha demostrado que las plaquetas apoptóticas pueden inducir la coagulación ≥50 veces más rápido que las plaquetas normales.
Un aumento en la producción de ROS mitocondriales en las plaquetas conduce a un estrés oxidativo severo que altera la producción de ATP y el potencial de la membrana mitocondrial que conduce a una mayor activación plaquetaria.
Esto puede explicar el número reducido de plaquetas en la enfermedad COVID-19 a pesar de la aparición de trombosis. Además, los pacientes con COVID-19 probablemente sufren de deterioro de la mitofagia debido al estrés causado por la hiperinflamación. En un contexto saludable, la mitofagia protege a las plaquetas del estrés oxidativo y la destrucción mitocondrial al eliminar las mitocondrias dañadas para prevenir la apoptosis plaquetaria; cuando se altera la mitofagia plaquetaria, que está implicada en la patogénesis de COVID-19, se produce un aumento de la apoptosis plaquetaria que contribuye a un aumento de la trombosis.
Por lo tanto, preservar la función mitocondrial de las plaquetas puede ser un medio adicional para disminuir el riesgo de eventos trombóticos potencialmente fatales en la patogénesis de COVID-19.
Por otro lado, relacionando esto con el punto previo de la sobrecarga de hierro en el COVID, la evidencia sugiere que dicha sobrecarga de hierro es un agente causante de disfunción plaquetaria. El exceso de hierro altera la función mitocondrial y favorece el estrés oxidativo. Se cree que existe una cierta asociación entre sobrecargas de hierro y niveles elevados de ROS.
Además, las plaquetas activadas pueden liberar mitocondrias dentro de microvesículas al medio extracelular al exponerse al estrés oxidativo. Estas mitocondrias pueden ser lisadas generando mediadores inflamatorios que promueven inflamación endotelial.
Por tanto, las mitocondrias extracelulares y sus “derivados” pueden representar mediadores críticos en la progresión del entorno inflamatorio que conduce a la coagulopatía asociada con las vías de señalización inflamatorias.
Las mitocondrias sueltas y las mitocondrias en microvesículas constituyen un subconjunto principal de vesículas extracelulares liberadas por monocitos activados, y su actividad proinflamatoria en las células endoteliales está determinada por el estado de activación de sus células parentales. Por lo tanto, las mitocondrias pueden representar mediadores intercelulares críticos en enfermedades cardiovasculares y otros entornos inflamatorios.
COVID y disbiosis
Es de gran importancia considerar la comunicación mitocondria-microbiota en COVID-19 por varias razones:
- Primero, algunos pacientes tienen síntomas gastrointestinales concurrentes, incluida diarrea.
- Se ha detectado material genético del virus en las heces de pacientes con neumonía COVID-19.
Estas observaciones indican la capacidad del SARS-CoV-2 para colonizar el tracto gastrointestinal, lo que perturbaría la microbiota intestinal. Curiosamente, el análisis metabolómico fecal sugirió posibles vías que vinculan la microbiota intestinal con la inflamación, lo que explicaría la predisposición de ciertos individuos a desarrollar COVID-19 severo. Abordar el impacto de la microbiota COVID-19 en la función mitocondrial brindaría nuevas vías para estrategias terapéuticas.
La interacción entre la microbiota y las mitocondrias parece ocurrir en ambos sentidos por medio de enlaces endocrinos, inmunes y humorales.
La microbiota intestinal comensal influye en las funciones mitocondriales relacionadas con la producción de energía, la biogénesis mitocondrial, el equilibrio redox y las cascadas inflamatorias. Por otro lado, las funciones mitocondriales podrían alterar la composición y la actividad de la microbiota intestinal. De hecho, como se describió anteriormente, en condiciones estresantes como las infecciones bacterianas o virales, las mitocondrias pueden modular las respuestas inmunitarias que conducen a una mayor inflamación. Esta respuesta inmune desequilibrada puede resultar en disbiosis.
Conclusiones
Para resumir todo esto que he explicado en pocas palabras y unas pocas píldoras que llevarse a casa:
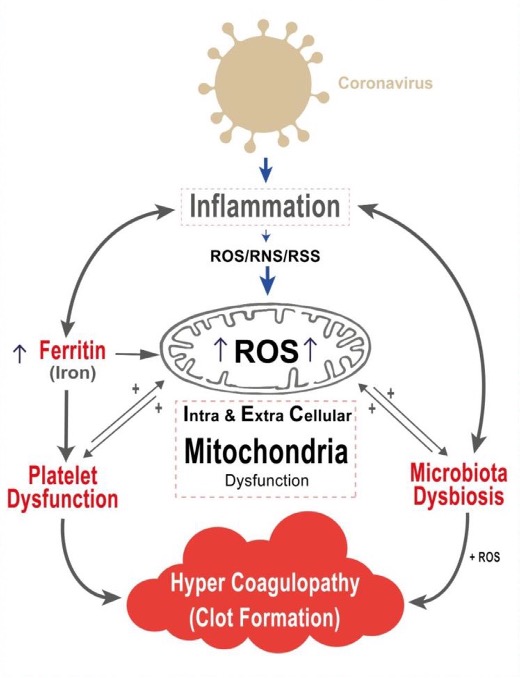
- La enfermedad por COVID-19 implica un estado inflamatorio
- Dicho estado inflamatorio implica la producción de gran cantidad de citokinas inflamatorias y está relacionado con la presencia de hiperferritinemia (sobrecarga de hierro) llevando a un aumento del estrés oxidativo y daño celular.
- La mitocondria es la organela fundamental de generación de las especies reactivas del oxígeno (ROS).
- El Aumento de ROS lleva a daño mitocondrial intra y extracelular.
- Este daño mitocondrial lleva a disbiosis intestinal.
- También disfunción plaquetaria que juega un papel fundamental en la formación de trombos.
- El daño mitocondrial lleva a la liberación de su contenido que agrava el estado inflamatorio en un estado de círculo vicioso que lleva a la progresión de la enfermedad por COVID-19.
Esta evidencia sobre la afectación mitocondrial, plaquetaria y disbiosis en procesos inflamatorios y COVID abre vías de investigación para nuevas estrategias terapéuticas y preventivas en esta grave enfermedad y otras que cursen con inflamación sistémica severa.
BIBLIOGRAFÍA
(1) Saleh J, Peyssonnaux C, Singh KK, Edeas M. Mitochondria and microbiota dysfunction in COVID-19 pathogenesis. Mitochondrion. 2020;54:1-7. doi:10.1016/j.mito.2020.06.008
(2) Zhang, D., Guo, R., Lei, L., Liu, H., Wang, Y., Wang, Y., Dai, T., Zhang, T., Lai, Y., Wang, J., Liu, Z., He, A.O., Dwyer, M., Hu, J., 2020a. COVID-19 infection induces readily detectable morphological and inflammation-related phenotypic changes in peripheral blood monocytes, the severity of which correlate with patient outcome. medRxiv 2020.03.24.20042655.
(3) Zhu, H., Santo, A., Jia, Z., Li, Y., 2019. GPx4 in bacterial infection and polymicrobial sepsis: involvement of ferroptosis and pyroptosis. React. Oxyg. Species 7, 154–160.
(4) Aguirre, J.D., Culotta, V.C., 2012. Battles with iron: manganese in oxidative stress pro- tection. J. Biol. Chem. 287, 13541–13548.
(5) Wang, L., Wu, Q., Fan, Z., Xie, R., Wang, Z., Lu, Y., 2017. Platelet mitochondrial dys- function and the correlation with human diseases. Biochem. Soc. Trans. 45, 1213–1223.
(6) Melchinger, H., Jain, K., Tyagi, T., Hwa, J., 2019. Role of platelet mitochondria: life in a nucleus-free zone. Front. Cardiovasc. Med. 6, 1–11.
(7) Gou, W., Fu, Y., Yue, L., Chen, G., Cai, X., Shuai, M., Xu, F., Yi, X., Chen, H., Zhu, Y., Xiao, M., Jiang, Z., Miao, Z., Xiao, C., Shen, B., Wu, X., Zhao, H., Ling, W., Wang, J., Chen, Y., et al., 2020. Gut microbiota may underlie the predisposition of healthy individuals to COVID-19. medRix 1–44.
(8) Green, D., Galluzzi, L., Kroemer, G., 2011. Mitochondria and the autophagy- inflammation-cell death axis in organismal aging. Science (80-.) 333, 1109–1112
(9) Lin S-J, et al. Calorie restriction extends yeast life span by lowering the level of NADH. Genes Dev. 2004;18:12–16.
(11) Imai S, Yoshino J. The importance of NAMPT/NAD/SIRT1 in the systemic regulation of metabolism and ageing. Diabetes Obes Metab. 2013;15(Suppl 3):26–33.
(12) Lin SJ, et al. Life span extension by calorie restriction in S. cerevisiae requires NAD and SIR2. Science. 2000;289:2126–2128.